بسم الله الرحمن الرحيم
السلام عليكم ورحمة الله وبركاته ..
اتحادCombination تفاعل يتم بين مادتين أو أكثر لتكوين مادة واحدة جديدة . يتم التعبير عن تفاعل الإتحاد بشكل عام كالآتي :
من الأمثلة على هذا النوع من التفاعلات تفاعل احتراق المغنيسيوم
اتزان كيميائي Chemical equilibrium
حالة تكون فيها سرعة التفاعل الأمامي مساوية لسرعة التفاعل العكسي ويعبر عادة عن التفاعل المتزن بأسهم متعاكسة .
من الأمثلة على الأنظمة المتزنة الاتزان الآتي :
احتراق Combustion
تفاعل المادة مع الأكسجين ، وينتج عنه طاقة .
عند حرق المادة يتكون أكسيد العنصر أو أكاسيد العناصر المحترقة .
فمثلاً :
عند حرق الكربون ( الفحم ) في جو شحيح الأكسجين يتكون أكسيد للكربون ( أول أكسيد الكربون ) :
عند حرق الكربون ( الفحم ) في جو غني بالأكسجين يتكون أكسيد للكربون ( ثاني أكسيد الكربون ) :
عند حرق المغنيسيوم يتكون أكسيد المغنيسيوم :
عند حرق الميثان يتكون أكسيد للكربون ( ثاني أكسيد الكربون ) ، وأكسيد للهيدروجين ( الماء ) :
احلال احادي Single displacement
تفاعل يتم فيه احلال عنصر نشط محل عنصر آخر أقل نشاطاً في أحد مركباته .
يتم التعبير عن تفاعل الإحلال الأحادي بشكل عام كالآتي :
من الأمثلة على هذا النوع من التفاعلات تفاعل محلول كبريتات النحاس مع فلز الخارصين :
حلال مزدوج Double displacement
تفاعل يتم بين مركبين ، بأن يحل الأيون الموجب من أحدهما محل الأيون الموجب في الآخر .
يتم التعبير عن تفاعل الإحلال المزدوج بشكل عام كالآتي :
من الأمثلة على هذا النوع من التفاعلات تفاعل محلول هيدروكسيد الصوديوم مع محلول حمض الهيدروكلوريك :
اختزال Reduction
عملية تكتسب فيها الذرة أو الأيون الكتروناً واحداً أو أكثر
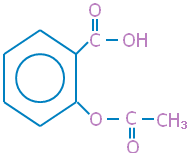
اسبرين Aspirin
مشتق لحمض الساليسيليك المستخرج من لحاء شجر الصفصاف ، واسمه أسيتيل حمض الساليسيليك ، ذو تأثير مسكن للألم وخافض للحرارة .
استبدال أروماتي Aromatic Substitution
تفاعل يتم فه استبدال ذرة أو مجموعة من الذرات بذرة أو مجموعة من الذرات في مركب أروماتي .
استخلاص Extraction
يعد الاستخلاص من أقدم العمليات الكيميائية فتحضير فنجان من القهوة أو الشاي يعد مثالاً على استخلاص النكهة والرائحة من أوراق الشاي أو حبيبات البن باستخدام الماء الساخن .
كما تعد عملية عزل الزيوت العطرية والمركبات الطبية من النباتات بواسطة المذيبات العضوية أمثلة أخرى على الاستخلاص .
يمكنك استخلاص مادة الكلوروفيل من ورقة نبات في البيت وذلك بوضع الورقة في كحول طبي ( سبيرتو ) لمدة دقيقتين ، تلاحظ بعدها تغير لون الكحول الى اللون الأخضر .
استر Ester
مركب عضوي ينتج من تفاعل الكحول مع الحمض الكربوكسيلي بوجود حمض قوي . وللإسترات رائحة تشبه رائحة بعض أنواع الفواكه ، لذلك فهي تستخدم لإضفاء نكهات الفواكه على الحلويات .
استر ثلاثيTriglyceride
جزيء زيت أو دهن ويسمى أيضاً ثلاثي غليسيريد ، ينشأ من ارتباط مول واحد من الغليسيرول مع ثلاثة مولات من الحموض الدهنية ، وينفصل عند تكونه ثلاثة مولات من الماء .
يتبع
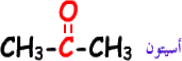
اسيتون Acetone
مركب عضوي ينتمي الى عائلة الكيتونات ، اسمه النظامي بربانون ، يحتوي على مجموعة الكربونيل CO كمجموعة وظيفية ، ويعد من أبسط أنواع الكيتونات ، ويستخدم لإزالة الطلاء عن الأظافر
اسمنت طبيعي Natural cement
المزيج الذي ينتج بتأثير الحرارة والضغط داخل باطن الأرض على الحجر الجيري والطفل .
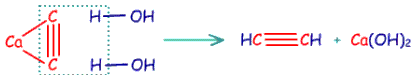
أسيتيلين Acetylene
مركب عضوي هيدروكربوني غير مشبع ، ينتمى الى عائلة الألكاينات ، واسمه حسب نظام الـ IUPAC ايثاين .
الصيغة الجزيئية : C2H2
الصيغة البنائية : H-C º C-H
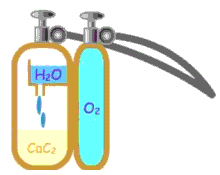 الأسيتيلين غاز عديم اللون ، له رائحة خفيفة في الصورة النقية ، أما الأسيتيلين الذي يتم الحصول عليه من الكربيد فله رائحة كريهه نظراً لوجود شوائب مثل كبريتيد الهيدروجين . يذوب الأسيتيلين في الماء بصورة جيدة ، ويتكثف بسهولة الى سائل يغلي عند درجة -83,6 5 . يحترق الأسيتيلين بلهب ساطع ، ويعطي كمية هائلة من الطاقة ، ولهذا السبب يستخدم الأسيتيلين في لحام وقطع المعادن . يحضر الأسيتيلين لأغراض اللحام من تفاعل كربيد الكالسيوم مع الماء .
الأسيتيلين غاز عديم اللون ، له رائحة خفيفة في الصورة النقية ، أما الأسيتيلين الذي يتم الحصول عليه من الكربيد فله رائحة كريهه نظراً لوجود شوائب مثل كبريتيد الهيدروجين . يذوب الأسيتيلين في الماء بصورة جيدة ، ويتكثف بسهولة الى سائل يغلي عند درجة -83,6 5 . يحترق الأسيتيلين بلهب ساطع ، ويعطي كمية هائلة من الطاقة ، ولهذا السبب يستخدم الأسيتيلين في لحام وقطع المعادن . يحضر الأسيتيلين لأغراض اللحام من تفاعل كربيد الكالسيوم مع الماء .
ويتم التفاعل وفق المعادلة الآتية :
اشعة القناة Canal Rays
حزمة من الأيونات الموجبة ، تنتج من تأين الغاز داخل أنبوب التفريغ الكهربائي ، وتسير عبر الثقوب الموجودة في القطب السالب ، وتسمى أحياناً الأشعة المصعدية .
اشعة تحت الحمراء Infrared rays
أمواج كهرمغناطيسية ، لها تردد أقل من تردد الأشعة الحمراء . اكتشفت الأشعة تحت الحمراء من قبل هيرزكل Herschel عام 1800 .
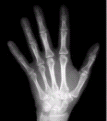
أشعة سينية X- Rays
تيار من الفوتونات ذات طاقة عالية ، تنتج من قصف العنصر بالكترونات ذات طاقة عالية .
اكتشفت الأشعة السينية من قبل العالم روينتجن Roentgn عام 1896 نتيجة ملاحظة أن الأشعة المهبطية عندما تنطلق في أنابيب التفريغ الكهربائي وتصطدم بالقطب الموجب ، تسبب اصدار اشعاعات من القطب الموجب ذات طاقة عالية ، ولعدم معرفته بماهية هذه الإشعاعات سماها أشعة ( X ) أو الأشعة السينية . وتعتمد طاقة الأشعة السينية على نوع مادة المصعد .
تستخدم الأشعة السينية في تصوير أجهزة الجسم .
أشعة غاما Gamma Rays
أمواج كهرمغناطيسية ذات طول موجي قصير وتردد عال ، لا شحنة ولا كتلة لها ، ولها قدرة عالية على الاختراق ، وتستخدم في الطب لعلاج الأورام السرطانية .
أشعة فوق بنفسجية Ultraviolet rays
أمواج كهرمغناطيسية ، لها تردد أكبر من تردد الأشعة البنفسجية ، وهي أشعة غير مرئية تستخدم لأغراض التعقيم ، ولها دور مهم في تكوين فيتامين ( د ) في الجسم ، ولكن إذا تعرض الجسم لهذه الأشعة لفترة طويلة تؤدي الى حدوث سرطان الجلد .
يتبع
أشعة مهبطية Cathode Rays
 سيل من الالكترونات ينتج عند امرار تيار كهربائي ذي جهد عال بين قطبين فلزيين في أنبوب التفريغ الكهربائي .
سيل من الالكترونات ينتج عند امرار تيار كهربائي ذي جهد عال بين قطبين فلزيين في أنبوب التفريغ الكهربائي .
أعداد الكم Quantum numbers
أعداد تحدد موقع وطاقة وشكل الفلك واتجاهه الفراغي ، كما تحدد حركة الإلكترون المغزلية حول نفسه أثناء دورانه حول النواة .
أعمدة صاعدة Stalagmite
بروزات تظهر من أرضية الكهوف الجيرية ، وهي عبارة عن ترسبات من كربونات الكالسيوم CaCO3 ، تتشكل بفعل سقوط قطرات الماء المشبع بالأيونات HCO3– , Ca2+ من سقف الكهف على أرضية الكهف الجيري وفقدانها غازيH2O , CO2 نتيجة التبخر وتترسب CaCO3 الموجودة فيها ، وبمرور الوقت تتراكم هذه الترسبات مكونة بروزات يزداد طولها بالتدريج وتتخذ أشكالاً جميلة تظهر على شكل أعمدة بارزة من أرضية الكهف ، وتعرف بالأعمدة الصاعدة .
أعمدة هابطة Stalactite
بروزات تتدلى من سقوف الكهوف الجيرية ، وهي عبارة عن ترسبات من كربونات الكالسيوم CaCO3 ، تتشكل بفعل سقوط قطرات الماء المشبع بالأيونات HCO3- , Ca2+ من سقف الكهف وفقدانها غازي H2O , CO2 نتيجة التبخر وتترسب CaCO3 الموجودة فيها ، وبمرور الوقت تتراكم هذه الترسبات مكونة بروزات يزداد طولها بالتدريج وتتخذ أشكالاً جميلة تتدلى من سقف الكهف ، وتعرف بالأعمدة الهابطة .
أكاسيد حمضية Acidic Oxides
مركبات تنتج من ارتباط الأكسجين مع أحد اللافلزات ، وله خواص حمضية .
أمثلة : CO2 , NO2 , SO3
وتنتج الصفات الحمضية لهذه الأكاسيد نتيجة لتكون محلول لأحد الحموض عند اذابتها في الماء .
مثال
أكاسيد قاعدية Basic Oxides
مركبات تنتج من ارتباط الأكسجين مع أحد الفلزات ، وله خواص قاعدية .
أمثلة : MgO , CaO
وتنتج الصفات القاعدية لهذه الأكاسيد نتيجة لتكون محلول لأحد القواعد عند اذابتها في الماء .
مثال :
أكتينيدات Actinides
عناصر الدورة السابعة في الجدول الدوري والتي ينتهي تركيبها بالمستوى f . أعدادها الذرية 89-103
اكسدة Oxidation
عملية تفقد فيها الذرة أو الأيون الكتروناً واحداً أو أكثر .
التأريخ الكربوني Carbon dating
استخدام نظير الكربون (14) في تقدير أعمار الأشياء التي كانت في يوم ما حية .
يتبع ..
ألدهيدات Aldehydes
مركبات عضوية تحتوي على مجموعة الكربونيل CO كمجموعة وظيفية ومميزة للألدهيدات ، وتحمل الألدهيدات الصيغة العامة :
أبسط الألدهيدات وأشهرها الميثانال ، ويسمى أيضاً فورمالدهيد ، ويستخدم في المختبرات كمحلول حافظ للحيوانات المحنطة ، وفي عمليات التخدير .

الدوز Aldose
سكر يحتوي على مجموعة كربونيل الدهيدية ( CO ) على ذرة الكربون الأولى في بنائه المفتوح .
من الأمثلة على هذا النوع من السكريات الغلوكوز الرازي Al_Razi
أبو بكر محمد بن زكريا ، عاش في الفترة ( 866 – 925 م ) وسمي الرازي نسبة الى مسقط رأسه الري وهي مدينة صغيرة قريبة من طهران .
زاول الرازي مهنة الطب أكثر من خمسين عاماً ، وقد استشاره الخليفة المعتضد بالله في أمر الموضع الذي يمكن أن يبني فيه البيمارستان
( المستشفى ) ببغداد ، فأمر أن يعلق في كل ناحية من بغداد قطعة لحم ، وأشار على الخليفة أن يبنى البيمارستان في الموضع الذي تأخر تعفن اللحم فيه ، وقد أصبح فيما بعد رئيساً للبيمارستان .
يعتبر الرازي من أهم الأطباء في العصور الوسطى ، وأكثرهم ابتكاراً وانتاجاً ، خاصة في مجال أمراض العيون ، واليه ينسب الفضل في تشخيص الحصبة والجدري والأمراض النسائية والتناسلية ، وقد أكد أن بعض الأمراض تنتقل بالوراثه ، وله عدة مؤلفات في الطب أهمها كتاب الحاوي الذي جمع فيه علوم الأقدمين في الطب .
أما في الكيمياء في وضع كتباً عدة في الكيمياء يصف فيها طريقة تحضير المواد ، ووصف الأجهزة المستخدمة لذلك ، وفي كتبه حاول الرازي أن ينقي علم الكيمياء من الشوائب كالخزعبلات والخرافات .
الرقم الهيدروجيني الأمثل Optimal pH value
أفضل رقم هيدروجيني pH يعمل عنده الأنزيم .
الفة الكترونية Electron affinity
الطاقة المصاحبة لإضافة الكترون الى الذرة .
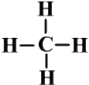
الكان Alkane
هيدروكربون مشبع ( جميع روابطه أحادية ) ، ينتمي الى المركبات العضوية، صيغته العامة CnH2n+2 .
أبسط أنواع الألكانات هوغاز الميثان :
الكان حلقي Cycloalkane
الكان صيغته العامة CnH2n حيث n = 3 , 4 , 5 , ………………
أبسط الألكانات الحلقية البروبان الحلقي ( سايكلوبروبان ) .
الصيغة الجزيئية للبروبان الحلقي : C3H6
الصيغة البنائية للبروبان الحلقي : 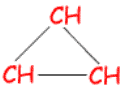
الكاين Alkyne
هيدروكربون غير مشبع ( يحتوي على رابطة ثلاثية ) ، ينتمي الى المركبات العضوية ، صيغته العامة CnH2n-2 .
أبسط أنواع الألكاينات غاز الأيثاين ( الأسيتيلين ) ، الذي يستخدم في لحام المعادن
الكترون Electron
جسيم يحمل شحنة سالبة ، يدور في مدارات حول النواة ، كتلته 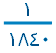 من كتلة البروتون أو النيوترون تقريباً .
من كتلة البروتون أو النيوترون تقريباً .
الكترونات التكافؤ Valence electrons
الكترونات غير رابطة Non bonding electrons
الكترونات توجد في مستوى الطاقة الأخير للذرة ولا تشارك في عمل الروابط.
ألنيكو Alnico
سبيكة تتصف بأنها تحتفظ بمغنطة دائمة أكثر من الحديد ، تتألف من الكوبالت والألومنيوم والنيكل والنحاس والحديد .
الكين Alkene
هيدروكربون غير مشبع ( يحتوي على رابطة ثنائية ) ، ينتمي الى المركبات العضوية ، صيغته العامة CnH2n .
أبسط أنواع الألكينات غاز الأيثين ( الايثيلين ) ، الذي يدخل في صناعة مبلمر متعدد ايثيلين
آلية التفاعل Reaction mechanism
مجموعة من الخطوات الأولية تمثل تتابع حدوث التفاعل وتكوين النواتج .
وكمثال على ذلك يتفاعل الأوزون مع أكسيد النيتروجين ( IV ) وفق المعادلة الآتية :
والتفاعل السابق لا يحدث مباشرة بخطوة واحدة ، وقد افترضت له الآلية الآتية :
تسمى الخطوتان السابقتان آلية التفاعل لأن مجموعهما يساوي التفاعل الأصلي .
أمونيا( نشادر) Ammonia
قاعدة ضعيفة صيغتها NH3 ، وتكتسب الصفات القاعدية لاحتوائها على زوج من الالكترونات غير رابطة على ذرة النيتروجين .
للأمونيا شكل الهرم الثلاثي بزاوية 107.3 5 بين روابطها . تدخل الأمونيا في صناعة سائل تنظيف الزجاج ، وله رائحة نفاذة ، لذا فهو يستخدم لمعاجة حالات الإغماء .
أميد Amide
مركب عضوي صيغته العامة
أبسط أنواع الأميدات المركب ميثاناميد
أميلوز Amylose
الجزء الذائب من النشا ، ويتكون من ارتباط ما يقارب الـ ( 1000 ) وحدة غلوكوز من نوع الفا برابطة ايثرية ، سلاسله غير متفرعة ، تخزنه النباتات بشكل مكثف نظراً لالتفاف سلاسله بشكل حلزوني .
أميلوبكتين Amylopectin
الجزء غير الذائب من النشا ، ويتكون من ارتباط عدد كبير من وحدات الغلوكوز من نوع الفا برابطة إيثرية ، سلاسله متفرعة .
أمين Amine
مركب عضوي يحتوي على مجموعة أمين كمجموعة وظيفية NH2 ، قاعدي التأثير لوجود زوج من الالكترونات غير رابطة على ذرة النيتروجين ، ويحمل الصيغة العامة RNH2 ، وهو بذلك يعد من مشتقات الأمونيا ( النشادر ) .
أبسط أنواع الأمينات المركب أمينو ميثان CH3NH2 .
أمونيوم Ammonium
أيون موجب صيغته NH4+i ، حمضي التأثير ، ينتج عن ارتباط الأمونيا بأيون هيدروجين برابطة تناسقية .
أنبوب اختبار Test tube
انبوب زجاجي يستخدم في المختبرات لأخذ عينات .
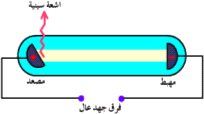
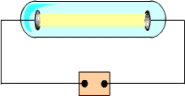
أنبوب تفريغ Discharge tube
أنبوب زجاجي يحتوي على غاز تحت ضغط منخفض ، وبه قطبان فلزيان ، وعند امرار تيار كهربائي ذو فرق جهد عال يتوهج الغاز داخل الأنبوب بلون يعتمد على نوع الغاز الموجود داخل الأنبوب .
استخدم أنبوب التفريغ الكهربائي في الأصل لاكتشاف وجود الالكترونات والأيونات الموجبة .
انجستروم Angestrom :
وحدة مسافة وتساوي 10 -10 من المتر
اندماج نووي Nuclear Fission
اتحاد أنوية خفيفة لتكوين نواة ثقيلة . ومن الأمثلة على هذا النوع من التفاعلات اندماج أنوية نظائر الهيدروجين لإنتاج ذرة هيليوم وكمية هائلة من الطاقة . ويعتقد أن هذا التفاعل هو المسؤول عن الطاقة الشمسية .
يتبع ,,
أنزيم Enzyme
عوامل مساعدة بروتينية ، تستخدم لإتمام التفاعلات الحيوية داخل الجسم ، وتعمل بتخصص عال ، فهو يعمل على مادة واحدة فقط أو مجموعة من متشابهه من المركبات ، أو على نوع معين من الروابط .
انشطار نووي Nuclear Fusion
إنشطار أنوية العناصر الثقيلة الى أنوية أصغر منها عند قصفها بمقذوف ذري .
لتفاعل الإنشطار النووي أهمية بالغة في توليد الطاقة الكهربائية ، ففي المفاعلات النووية يتم قصف أنوية اليورانيوم بنيوترون ، وينشأ عن ذلك تكون كتلتين صغيرتين وكمية هائلة من الطاقة ، وتستخدم هذه الآلية أيضاً في القنابل النووية .
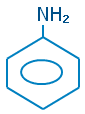
أنيلين Anilin
مركب عضوي أروماتي يحتوي على مجموعة أمين ( NH2 ) مرتبطة بحلقة بنزين ، واسمه النظامي أمينوبنزين .
أوبنهيمر Oppenheimer
فيزيائي نووي أمريكي ( 1904 – 1967 ) أسهم في انتاج القنبلة النووية بوصفه رئيساً لمشروع مانهاتن .
أوزون Ozone
جزيء يحتوي على ثلاث ذرات أكسجين ، صيغته O3 ، وينتج في طبقات الجو العليا بتأثير الأشعة فوق البنفسجية أو البرق على الأكسجين O2 .
تكمن أهمية الأوزون في طبقات الجو العليا في حماية الجسم من الأشعة البنفسجية المسببة للسرطان وبخاصة سرطان الجلد ، ويستخدم الأوزون في تعقيم المياه نظراً لقدرته على قتل الجراثيم
أول أكسيد الكربون Carbon monoxide
أحد أكاسيد الكربون ، يتكون بفعل الإحتراق غير التام للمركبات المحتوية على الكربون كالنفط والفحم ، صيغته CO ، سام ، يكتسب سميته من قوة ارتباطه بهيموغلوبين الدم فارتباطه بالهيموغلوبين أقوى من ارتباط كل من الأكسجين وثاني أكسيد الكربون .
يتم معاجة التسمم بأول أكسيد الكربون عن طريق استنشاق الهواء النقي إذا كان التسمم بسيطاً ، أما التسمم بكميات كبيرة من أول أكسيد الكربون فتتم معالجته بحقن المتسمم بأزرق الميثيلين الذي يستطيع أن يحل محل أول أكسيد الكربون في هيموغلوبين الدم .
ايثر Ether
مركب عضوي يتميز بوجود ذرة أكسجين بين ذرتي كربون C-O-Cويحمل الإيثر الصيغة العامة R-O-R .
أبسط الإيثرات تركيباً المركب ثنائي ميثيل ايثرCH3OCH3 ، وأكثر الإيثرات شهرةً المركب ثنائي ايثيل ايثر .
اينشتاين Einstein
البرت اينشتاين Albert Einstein ( 1879 – 1955 ) فيزيائي أمريكي ، الماني المولد ، صاحب النظرية النسبية ، منح جائزة نوبل في الفيزياء عام 1921 ، كان وراء فكرة انتاج الولايات المتحدة الأمريكية للقنبلة النووية .
أيوباك IUPAC
المنظمة الدولية للكيمياء البحتة والتطبيقية ، وتعنى بوضع قواعد لتسمية المركبات العضوية ، واسمها مشتق من أوائل الحروف في اسم المنظمة :
International Union for Pure and Applied Chemistry
أيون Ion :
ذرة أو مجموعة ذرات مشحونة كهربائياً بشحنة سالبة أو موجبة .
أيون الهيدرونيوم Hydronium ion :
أيون ناتج من ارتباط البروتون ( أيون الهيدروجين ) مع جزيء ماء برابطة تناسقية .
H+ + H2O ® H3O+
أيون مزدوج Zwitterion
أيون ناتج عن انتقال البروتون من مجموعة الكربوكسيل الحمضية الى مجموعة الأمين القاعدية في الحمض الأميني .

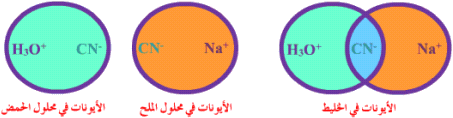
أيون مشترك Common Ion
الأيونين الشبيهين عند خلط محلول حمض مع ملحه أو محلول قاعدة مع ملحها .
كمثال على ذلك افرض أن لديك محلولاً لحمض الهيدروسينيك HCN .
ولديك محلولاً آخر لملح سيانيد الصوديوم NaCN .
وعند خلط المحلولين معاً يكون الأيون المشترك هو أيون السيانيد CN– .
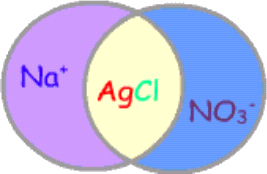
أيونات متفرجة Spectator ions
أيونات لا تشارك في التفاعلات الأيونية .
كمثال على ذلك :
إذا تم تحضير محلول نيترات الفضة AgNO3 تكون الأيونات في المحلول هي :
وإذا تم تحضير محلول آخر لكلوريد الصوديوم NaCl تكون الأيونات في المحلول هي :
وإذا تم خلط المحلول معاً يلتقي أيوني Ag+ وCl- ويكونان راسباً أبيض اللون عبارة عن كلوريد الفضة شحيح الذوبان في الماء ويتبقى أيونين في المحلول دون تغير هما أيوني Na+ و NO3- ويسميان أيونين متفرجين لعدم حدوث أي تغير عليهما .
أيونات معقدة Complex Ions
م/ن للفائده ..
موفقين ..
مآ أقول غير , آلله يرحم أيآمج يآلكيميآ (=
يزآج آلله خير , ع آلمصطلحآت آلكيميآئية ،،
تم آلتقييم غلآي ؛
أستغفرك يا رب من كل ذنب


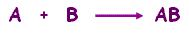
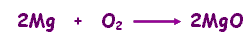









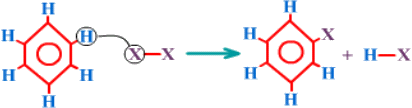






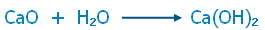
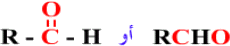



 من كتلة البروتون أو النيوترون تقريباً .
من كتلة البروتون أو النيوترون تقريباً .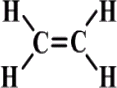
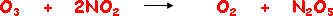
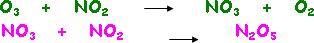
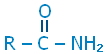
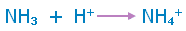



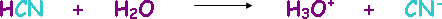




 الأهداف يصف الأعداد الكمية الأربعة، ومدلول كل منهم، والعلاقة بينهم.
الأهداف يصف الأعداد الكمية الأربعة، ومدلول كل منهم، والعلاقة بينهم.
 مثال (1-3):
مثال (1-3):  (أ) الفلك s (ب) الأفلاك p
(أ) الفلك s (ب) الأفلاك p  شكل (1-9): الحركة المغزلية للإكترون
شكل (1-9): الحركة المغزلية للإكترون  وايد حلو و اتمنى يعجب الباقين
وايد حلو و اتمنى يعجب الباقين