أصغر من مثقال ذرة
جاء ذكر الذرة في القرآن الكريم في ستة مواضع، حيث أشار القرآن إلى أنها ذات ثقل ووزن، وإلى أنه يوجد ما هو أصغر منها، كما تحدث عن مواضعها، وكيف أنها تشغل السماوات والأرض، قال تعالى: {إِنَّ اللهَ لاَ يَظْلِمُ مِثْقَالَ ذَرَّةٍ وَإِن تَكُ حَسَنَةً يُضَاعِفْهَا وَيُؤْتِ مِن لَّدُنْهُ أَجْرًا عَظِيمًا} (النساء: 40).
{وَمَا يَعْزُبُ عَن رَّبِّكَ مِن مِّثْقَالِ ذَرَّةٍ فِي الأَرْضِ وَلاَ فِي السَّمَاءِ وَلاَ أَصْغَرَ مِن ذَلِكَ وَلاَ أَكْبَرَ إِلاَّ فِي كِتَابٍ مُّبِينٍ} (يونس: 61).
{لاَ يَعْزُبُ عَنْهُ مِثْقَالُ ذَرَّةٍ فِي السَّمَاوَاتِ وَلاَ فِي الأَرْضِ وَلاَ أَصْغَرُ مِن ذَلِكَ وَلاَ أَكْبَرُ إِلاَّ فِي كِتَابٍ مُّبِينٍ} (سبأ: 3).
{قُلِ ادْعُوا الَّذِينَ زَعَمْتُم مِّن دُونِ اللهِ لاَ يَمْلِكُونَ مِثْقَالَ ذَرَّةٍ فِي السَّمَاوَاتِ وَلاَ فِي الأَرْضِ وَمَا لَهُمْ فِيهِمَا مِن شِرْكٍ وَمَا لَهُ مِنْهُم مِّن ظَهِيرٍ} (سبأ: 22).
وقوله تعالى {فَمَن يَعْمَلْ مِثْقَالَ ذَرَّةٍ خَيْرًا يَرَهُ وَمَن يَعْمَلْ مِثْقَالَ ذَرَّةٍ شَرًّا يَرَهُ} الزلزلة: 7،8).
وكلمة الذرة في اللغة العربية نسبة إلى نوع ضئيل الحجم جدا من النمل يطلق عليه النمل الأحمر، وهو أصغر أنواع النمل، وتطلق على ما يُرى من هباء، والجسيمات الدقيقة التي تبدو لنا في أشعة الشمس عندما تدخل من النافذة أو أي ثقب ضيق.
والمعنى البياني المقصود بها في الآيات هو التصغير والتقليل، إلا أن الآيات تظهر أن هناك ما هو أصغر من الذرة، وهى حقيقة علمية.
الذرة وحدة بناء الكون
قال الإمام علي عليه السلام (إذا شققت الذرة وجدت فيها كونا)
ساد في القدم الاعتقاد بأن الذرة تعني الجوهر الذي لا يتجزأ إلى ما هو أصغر. وقد ظل هذا الاعتقاد قائمًا حتى عام 1789، عندما عثر العالم الألماني "مارتن كلابروث" على عنصر يصدر ومضات ضوئية في الظلام، لكنه لم يتمكن هو أو غيره من العلماء من وضع تفسير لهذه الظاهرة الغريبة. وتكريما لكوكب يورانوس أو أورانوس الذى كان قد اكتشف في نفس التوقيت أطلق عليه اسم "يورانيوم".
مضى قرن من الزمان والمادة الجديدة في عزلتها كما لو كانت أعجوبة في معامل الأبحاث، حتى استطاعت العالمة البولندية ماري كوري اكتشاف عناصر الثوريوم والبولونيوم والراديوم، وبذا تأكدت ظاهرة النشاط الإشعاعي الذاتي لبعض العناصر الموجودة في الطبيعة.
استفاد رذرفورد أبو الطاقة الذرية من هذه الظاهرة في دراسة تركيب الذرة، وقد عرف فيما بعد أن المواد المشعة تقذف بجسيمات يطلق عليها "ألفا" أو إشعاع بيتا وجاما؛ وفكر رذرفورد فيما سيحدث لو قام بتعريض رقاقة من الذهب لمصدر يقذف بجسيمات ألفا. وقد كان من المتوقع أحد احتمالين: الأول أن تنفذ جسيمات ألفا من رقاقة الذهب مخترقة إياها، أو أن تنفذ بداخلها وتستقر بها محدثة بعض التغييرات في تركيبها. ولكن كانت المفاجأة في نتائج التجربة..
ففي الوقت الذي نفذ فيه عدد كبير من جسيمات ألفا خلال الرقاقة دون أن تغير من اتجاهها انحرف البعض بزاويا مختلفة، كما ارتد البعض الآخر عائدًا للخلف. وقد استغرب رذرفورد النتائج، وعلق عليها قائلا: "لقد كان الأمر غريبا، تمامًا كما أطلقت قذيفة من عيار 15 بوصة على ورقة رقيقة، فلم تنفذ خلالها، وإنما ارتدت إليك لتصيبك".
وبعد تفكير عميق استنتج أن الظاهرة تعود إلى أن جسيمات ألفا موجبة الشحنة قابلت في طريقها في رقاقة الذهب جسمًا آخر له نفس الشحنة؛ وهو ما يعد تطبيقًا لقاعدة علمية؛ مفادها أن "الأجسام متشابهة الشحنة تتنافر، والأجسام مختلفة الشحنة تتجاذب".
واستنتج رذرفورد أن كتلة وشحنة هذا الجسم الموجود داخل نطاق ذرات الذهب كانتا كبيرتين ومركزتين جدًا؛ لدرجة أن جسيمات ألفا قد انحرفت جانبا، بل وإلى الخلف على الرغم من سرعتها الكبيرة التي تصل لحوالي 20 ألف كم في الثانية.
وبعد سنتين من البحث تم فيهما قذف كل مكان محتمل بالذرة، تم التأكد من صحة الاستنتاج، وقد أطلق على هذا الجزء "النواة"، وتبين أنها تشغل حيزا صغيرا جدا داخل الذرة، إلا أنها تتركز فيها غالبية كتلتها، وكان هذا أول باب يفتح أعين العلماء على أن الذرة تتألف من مكونات أصغر، ولكن يبقى السؤال: ماذا يشغل الجزء الباقي من الذرة؟
عالم من الفراغ
تتخذ الجزيئات أشكالاً هندسية
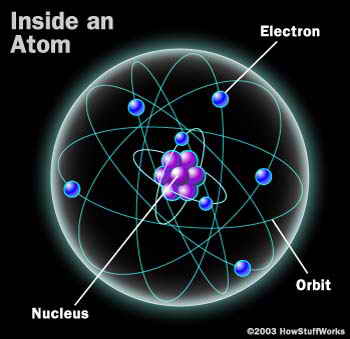
توصل العالم البريطاني ج.ج.طومسون قبل اكتشاف رذرفورد إلى أن هناك جسيمات دقيقة تحمل شحنة سالبة أقل كثيرًا من كتلة الذرة، مسئولة عن توصيل وحمل الكهرباء، أطلق عليها مصطلح "الإلكترونات". ومن ناحية أخرى تبين أن النواة ذاتها تستمد شحنتها الموجبة من جسيمات أخرى بداخلها تعرف بالبروتونات، وهي جسيمات يعادل كتلة الواحد منها كتلة الإلكترون 1836 مرة.
وكان شادويك الفيزيائي الإنجليزي هو الآخر قد قام في عام 1923 بقذف معدن البريليوم بطلقات من جسيمات ألفا؛ حيث كانت المفاجأة انطلاق دقائق لها كتلة غاز الهيدروجين، ولا تحمل أي شحنة كهربية، وقد أطلق على هذه الدقائق اسم النيوترونات؛ وهو ما يعني "الدقائق المحايدة". وبذلك يكون شادويك قد أزاح الستار عن مكون جديد من مكونات الذرة.
وفي ضوء هذه الكشوفات اكتملت صورة جديدة للذرة في ضوء العلم الحديث؛ حيث قدر العلماء قطر الذرة بأنه يبلغ 10-8 سم، ويقع في مركزها نواة موجبة الشحنة تتركز فيها معظم كتلة الذرة، وذلك على الرغم من الحجم الصغير جدا الذي تشغله؛ حيث يقدر حجمها بـ10-13، وبالمقارنة بالحجم الكلي للذرة يتضح أنها تشغل حيزا يبلغ 1: 100000 من حجم الذرة.
وتتكون النواة من نوعين من الجسيمات الصغرى؛ هي البروتونات موجبة الشحنة، والنيوترونات وتحمل شحنة متعادلة؛ لذا فإن النواة هي الأخرى موجبة الشحنة. وتبلغ كتلة البروتون الواحد (1.673× 10-24) جم، بينما تبلغ كتلة النيوترون (1.675× 10-24) جم، وهنا تبرز الحكمة الربانية في اقتران مصطلح "الذرة" بلفظة "مثقال" في كل الآيات التي وردت بها؛ فعلى الرغم من الصغر المتناهي لمكونات الذرة؛ فإن لكل منها وزنا محددا. وتدور حول النواة جسيمات متناهية في الصغر ذات شحنة سالبة تعرف بالإلكترونات.
الذرة تتألف من دقائق صغرى
يجدر الذكر إلى أن بنية كل الذرات الموجودة في الكون واحدة، إلا أنها تختلف باختلاف عدد البروتونات داخلها، وتؤلف الذرات فيما بينها الجزيئات المادية.
وتتألف مكونات الذرات والجزيئات التي تعد النواتج النهائية لعملية الخلق من دقائق صغرى، تعرف بـ"الجسيمات دون الذرية" أو "الجسيمات الأساسية"، ويحلو للبعض أن يطلق عليها "بذور المادة"؛ حيث تعد لبنات البناء المشتركة لكل مادة الكون. وقد انبثقت هذه الجسيمات خلال اللحظات الأولى من عمرالكون مع حدوث الانفجار العظيم.
وربما يدهش الغالبية إذا علموا أن حبة مفردة من السكر أو الرمل بها عالم خفي يمتد لأبعاد سحيقة لا يعلم مداها إلا الله. وقد توصل العلم الحديث باستخدام المجهر الإلكتروني إلى أن هذه الأشكال المفردة من المادة تتألف من بلورات منتظمة ثلاثية أو رباعية وما هو أكثر من ذلك، بعضها يكون على شكل الهرم أو المثلث أو المربع أو نجمة سداسية أو ثمانية وما إلى ذلك من الأشكال العجيبة والمتفردة.
وفي حين يعتقد أن الالكترونات من الجسيمات الأولية -أي أنها لا تتألف من جسيمات أصغر- فإنه قد تأكد للعلماء خلال الأربعين سنة الماضية أن البروتونات والنيوترونات تتألف من جسيمات أصغر أطلق عليها الكواركات. وعند التعامل مع جسيمات على مستوى الكواركات نكون قد دخلنا نطاقا جديدا من الأحجام هو 10-15 من السنتيمتر، أو ما يطلق عليه الفيمتو..
فسبحان الله خالق الكون والملكوت
الله يعطيج الصحة والعافية
بارك الله فيج..
وتسلم يمناج..
موفقين يارب,,
الله يسلمج
اشكرج ع مرورج الرائع